今天给同学们准备的是有关无机非金属元素中的氯元素知识汇总,同学们在空余时间可以看看车车的知识会总,让自己的知识保持新鲜度,才不会陷入迷茫和浮躁的心理。
氯的知识点汇总
一、氯元素
1.存在:在海水中主要以NaCl的形式存在。
2.原子结构
性质:最外层有7e-,易得到1个电子形成Cl-,性质很活泼,表现为典型的非金属性。强氧化性
自然界中有没有游离态的氯,氯元素在自然界以化合态形式存在
二、氯气(Cl2)
(一)物理性质:
1.颜色:黄绿色。
2.闻气味:刺激性气味,(有毒,请注意闻气体气味的方法)。
3.密度比空气大。
(二)化学性质:
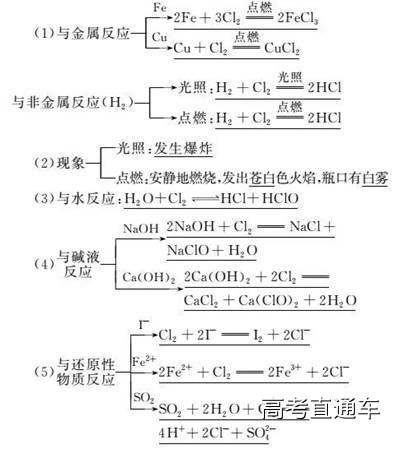
1.与金属反应:
与钠反应:2Na+ Cl2== 2NaCl 钠在氯气中燃烧,发出黄色火焰,产生白烟
与铁反应:2Fe + 3Cl2 == 2FeCl3
现象:红热的铁丝在Cl2中剧烈燃烧,产生红棕色烟(而不产生火焰),溶于水为黄色溶液。
与铜反应:Cu + Cl2 == CuCl2
现象:红热的铜丝在Cl2中剧烈燃烧,产生棕黄色烟(但不会产生火焰),溶于水为蓝色溶液。
结论:氯气具有强氧化性,①在加热或点燃的条件下,与绝大多数金属直接化合,②把变价金属从0价氧化为最高价。如:CuCl2、FeCl3 注意:例如:干燥的氯气在常温下不与铁反应所以可用钢瓶储存氯气
2、氯气与非金属反应
(1)氯气与氢气的反应:H2+Cl2=== 2HCl
a现象:氢气在氯气中安静燃烧,发出苍白色火焰,瓶口呈白雾状
白雾——生成的HCl与空气中的水蒸气结合形成的盐酸(氢氯酸)小液滴。
b现象:H2、Cl2混合光照:发生爆炸,产生白雾。
(2)与磷反应:氧气不足:2P+ 3 Cl2==2PCl3(白雾)液态
氧气充足:2P+ 5 Cl2==2PCl5(白烟)固态(指出氧化剂和还原剂)
(3)氯气与水反应:Cl2+H2O===HCl + HClO(次氯酸)
3、次氯酸的性质:
a、弱酸性:酸性:HClO< H2CO3 b、不稳定性:2HClO=2HCl+O2↑
c、强氧化性:可用于自来水的杀菌、消毒。
d、漂白作用:能漂白一些有色物质(有色纸条、布条、花瓣褪色),可用做漂白剂。
氯水(新制)的成分:
氯水是含Cl2、HCl、HClO三种溶质的混合溶液,其中含有三种分子(H2O、Cl2、HClO)和四种离子(H+、Cl-、ClO-、OH-)久置氯水相当于稀盐酸:实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
久置氯水成分:分子:H2O 离子:H+,Cl-,OH-
结论:氯水有漂白性,氯水中的HClO有强氧化性,干燥的氯气无漂白性,花瓣中的水与Cl2反应生成了HClO
4、氯气与碱的反应
2NaOH+Cl2==NaCl+NaClO+H2O 工业上和实验室中常用NaOH溶液吸收氯气尾气漂白液的主要成分。
2Ca(OH)2+2Cl2==CaCl2+Ca(ClO)2+2H2O 漂白粉的主要成分:Ca(ClO)2。
漂白原理: Ca(ClO)2+CO2+H2O=CaCO3+2HClO 、Ca(ClO)2+2HCl=CaCl2+2HClO漂白粉、漂粉精、漂白液等必须密封保存,并要避光防潮。为什么?
5、与盐溶液的反应
与FeCl2、NaBr、KI等盐溶液反应(表现氯气的强氧化性)
2Fe2++ Cl2=== 2Fe3++ 2Cl- Cl2+ 2Br-=== 2Cl-+ Br2 Cl2+ 2 I-=== 2Cl-+ I2
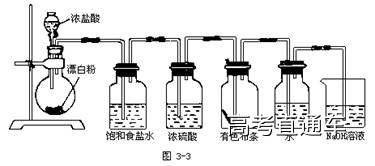
6、氯气的实验室制备
三、氯离子的检验
方法:先加稀硝酸酸化,再加入AgNO3溶液,产生白色沉淀,则含Cl-.
原理:Cl-+ Ag+= AgCl
酸化原因:CO32-+ 2Ag+= Ag2CO3
Ag2CO3+2H+=CO2+ 2Ag++H2O
考点汇总
考点一 氯及其化合物的性质和应用
1.氯气的物理性质
颜色 | 状态 | 气味 | 密度 | 毒性 | 溶解性 |
黄绿色 | 气体 | 刺激性气味 | 比空气大 | 有毒 | 可溶于水 |
2.氯气的化学性质
(1)次氯酸(HClO)
①不稳定性:见光易分解,化学方程式为2HClO=光照=2HCl+O2↑。
②弱酸性:比碳酸酸性弱,电离方程式为HClO→H++ClO-。
③强氧化性:具有漂白性。
(2)Ca(ClO)2的主要化学性质
①Ca(ClO)2是漂白粉的有效成分,它的稳定性比HClO强。
②水解显碱性,其水解离子方程式ClO-+H2O—HClO+OH-。
③与酸反应生成HClO,作为漂白或消毒剂的原理可用化学方程式表示为:
Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓。
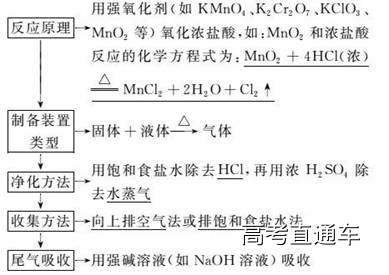
考点二 氯气的实验室制法
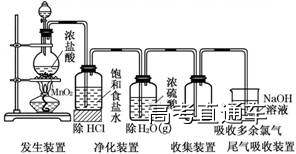
1.实验室制取、收集干燥纯净氯气的装置
2.验满方法
(1)将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
(2)将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
(3)实验室制取Cl2时,常常根据氯气的颜色判断是否收集满。
3.注意事项
(1)必须用浓盐酸,稀盐酸不反应。
(2)为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl挥发。
(3)实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。
(4)制Cl2的装置,可用于具有“固体(或液体)+液体―△→气体”特点的反应。
(5)尾气吸收时,不能使用澄清的石灰水,因为石灰水浓度太小,吸收不完全。
考点三 卤素的性质及X-的检验
1.结构与性质
卤素位于元素周期表中第ⅦA族,包括:氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)。卤素原子最外层都有7个电子,都是典型的非金属元素,其单质具有相似的化学性质。
(1)卤素单质和H2的反应:X2+H2===2HX。
(2)卤素单质和H2O的反应:X2+H2O=HX+HXO(X为Cl、Br)。
(3)卤素间的置换反应:
将氯水滴入溴化钠溶液:Cl2+2NaBr===2NaCl+Br2。
将溴水滴入碘化钾溶液:Br2+2KI===2KBr+I2。
2.特殊性
卤素单质及其化合物除了具有共性外,都有其特殊性质。
(1)氟:
①无正价,非金属性最强,F-的还原性最弱。
②2F2+2H2O===4HF+O2,与H2反应在暗处即爆炸。
③HF是弱酸,能腐蚀玻璃,故应保存在铅制器皿或塑料瓶中;有毒;在HX中沸点最高。
(2)溴:
①Br2是深红棕色液体,易挥发。
②Br2易溶于有机溶剂。
③盛溴的试剂瓶中加水,进行水封,保存液溴不能用橡胶塞。
(3)碘:
①I2遇淀粉变蓝色。
②I2加热时易升华。
③I2易溶于有机溶剂。
④食用盐中加入KIO3可防治甲状腺肿大。
3.卤素离子的检验
考点四 卤素单质的工业制法
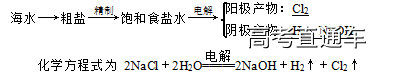
1.氯的提取——氯碱工业
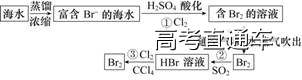
2.海水提取溴
(1)流程
(2)发生反应的化学方程式
①2NaBr+Cl2===Br2+2NaCl;
②Br2+SO2+2H2O===2HBr+H2SO4;
③2HBr+Cl2===2HCl+Br2。
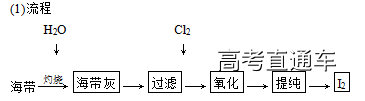
3.海带中提取碘
(2)发生反应的化学方程式:Cl2+2I-===I2+2Cl-。