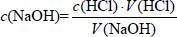高考化学:酸碱中和滴定实验(非常重要,一定掌握)
1.酸碱中和滴定
(1)实验原理
利用酸碱中和反应,用已知浓度的酸(碱)来测定未知浓度的碱(或酸)的实验方法。以标准盐酸滴定待测的氢氧化钠溶液,待测的氢氧化钠溶液的物质的量浓度为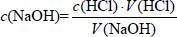
(2)实验用品
蒸馏水、0.1000 mol/L盐酸溶液、0.1000 mol/L NaOH溶液、酚酞指示剂、甲基橙指示剂;pH计、锥形瓶、烧杯、酸式和碱式滴定管、滴定管夹、铁架台。
(3)实验装置
(4)实验步骤
①滴定前的准备工作。滴定管:查漏→水洗→润洗→装液→赶气泡→调液面→记录初始读数;锥形瓶:水洗→装液→滴加指示剂。②滴定。左手控制滴定管,右手不停摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化。酸碱中和滴定开始时和达到滴定终点之后,测试和记录pH的间隔可稍大些,如每加入5~10 mL酸(或碱),测试和记录一次;滴定终点附近,测试和记录pH的间隔要小,每滴加一滴测一次。③数据处理。
实验滴定
注意:①最后一滴:必须说明是滴入“最后一滴”溶液。
②颜色变化:必须说明滴入“最后一滴”溶液后溶液“颜色的变化”。
③半分钟:必须说明溶液颜色变化后“半分钟内不恢复原来的颜色”。
④读数时,要平视滴定管中凹液面的最低点读取溶液的体积。
(5)数据处理
按上述操作重复二至三次,求出用去标准盐酸体积的平均值及待测碱液体积的平均值,根据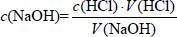
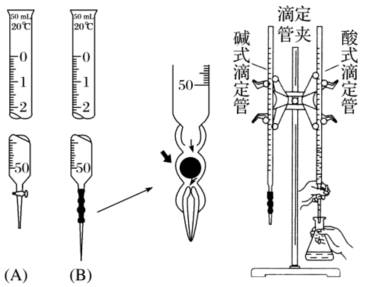
(6)滴定曲线
酸碱滴定曲线是以酸碱中和滴定过程中滴加酸(或碱)的量为横坐标,以溶液pH为纵坐标绘出的一条溶液pH随酸(或碱)的滴加量而变化的曲线。它描述了酸碱中和滴定过程中溶液pH的变化情况,其中酸碱滴定终点附近的pH突变情况(如上滴定曲线图),对于酸碱滴定中如何选择合适的酸碱指示剂具有重要意义。
2.误差分析
(1)原理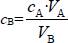
(2)误差分析
以标准酸溶液滴定未知浓度的碱溶液(酚酞作指示剂)为例,常见的因操作不当而引起的误差有:
步骤 | 操作 | VA | cB |
洗涤 | 酸式滴定管未用标准溶液润洗 | 变大 | 偏高 |
碱式滴定管未用待测溶液润洗 | 变小 | 偏低 | |
锥形瓶用待测溶液润洗 | 变大 | 偏高 | |
锥形瓶洗净后还留有蒸馏水 | 不变 | 无影响 | |
取液 | 量取碱液的滴定管开始有气泡,放出液体后气泡消失 | 变小 | 偏低 |
滴定 | 酸式滴定管滴定前有气泡,滴定终点时气泡消失 | 变大 | 偏高 |
振荡锥形瓶时部分液体溅出 | 变小 | 偏低 | |
酸式滴定管中部分酸液滴出锥形瓶外 | 变大 | 偏高 | |
溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化 | 变大 | 偏高 | |
读数 | 滴定前读数正确,滴定后俯视读数(或“前仰后俯”) | 变小 | 偏低 |
滴定前读数正确,滴定后仰视读数(或“前俯后仰”) | 变大 | 偏高 | |
两次滴定所消耗酸液的体积相差太大 | 无法判断 | ||
3.酸碱中和滴定拓展应用
中和滴定操作不仅适用于酸碱中和反应,还可以迁移应用于氧化还原反应、NaOH和Na2CO3混合溶液与盐酸的反应及沉淀反应。
(1)氧化还原滴定法
①原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质。
②实例
a.酸性KMnO4溶液滴定H2C2O4溶液
原理:2MnO4++6H++5H2C2O4===10CO2↑+2Mn2++8H2O
指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入一滴酸性KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色,说明到达滴定终点。
b.Na2S2O3溶液滴定碘液
原理:2Na2S2O3+I2===Na2S4O6+2NaI
指示剂:用淀粉作指示剂,当滴入一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点。
(2)双指示剂滴定法(以盐酸滴定NaOH和Na2CO3的混合溶液为例)
酚酞作指示剂:NaOH+HCl===NaCl+H2O
Na2CO3+HCl===NaCl+NaHCO3
甲基橙作指示剂:NaHCO3+HCl===NaCl+CO2↑+H2O
(3)沉淀滴定法(利用生成沉淀的反应)
应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl−、Br−或I−的含量。
【考试规范答题】
滴定管检查是否漏水操作
①酸式滴定管:关闭活塞,向滴定管中加入适量水,用滴定管夹将滴定管固定在铁架台上,观察是否漏水,若2分钟内不漏水,将活塞旋转180°,重复上述操作。
②碱式滴定管:向滴定管中加入适量水,用滴定管夹将滴定管固定在铁架台上,观察是否漏水,若2分钟内不漏水,轻轻挤压玻璃球,放出少量液体,再次观察滴定管是否漏水。
滴定管赶气泡的操作
①酸式滴定管:右手将滴定管倾斜30°左右,左手迅速打开活塞使溶液冲出,从而使溶液充满尖嘴。
②碱式滴定管:将胶管弯曲使玻璃尖嘴向上倾斜,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,即可赶出碱式滴定管中的气泡。
【例题】
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂。
(1)用标准盐酸滴定待测的NaOH溶液时,左手控制酸式滴定管的活塞,右手振荡锥形瓶,眼睛注视______。直到当加入一滴盐酸后,溶液由黄色变为橙色,并_____为止。
(2)下列操作中可能使所测NaOH溶液的浓度偏低的是_____。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始时仰视读数,滴定结束时俯视读数
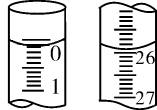
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为____mL,终点读数为____mL,所用盐酸的体积为____mL。
【答案】
(1)锥形瓶内溶液颜色的变化 半分钟内不褪色 (2)D
(3)0.10 25.90 25.80
【解析】
(1)滴定实验中规范操作:左控塞,右摇瓶,眼睛注视锥形瓶内溶液颜色的变化。
(2)误差分析应根据