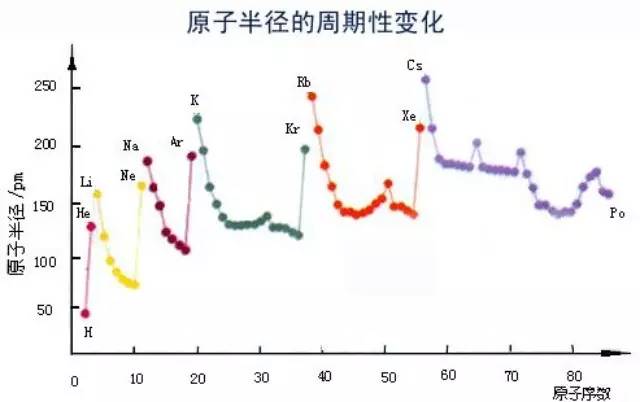
原子和单核离子半径大小比较“三步曲”:
第一步先看电子层数,因为其半径大小的决定因素是电子层数。电子层数越多,其半径越大。
第二步在电子层数相同的情况下看核电荷数,因为核电荷数的多少是影响半径大小的次要因素。而核电荷数越多,其半径越小。
第三步在电子层数和核电荷数相同的情况下看电子数,核外电子数是影响半径大小的最小因素。核外电子数越多,其半径越大。
值得注意的是此三步不可颠倒。
例:
一、原子半径的比较
(一)同一主族元素原子半径的大小,主要看电子层数。电子层数越多,则离子半径越大。
如rF-<rCl-<rBr-<rI-;
rLi+<rNa+<rK+<rRb+;
(二)同周期主族元素离子半径的大小,由于离子有阴、阳离子之分,因此,同周期主族元素离子半径的比较,有两种情况:
①同周期主族元素的阳离子一、原子半径的比较
(1)同一主族元素原子半径的大小,主要看电子层数。电子层数越多,则原子的半径越大。
如rN<rP<rAs<rSb
rLi<rNa<rK<rRb;
(2)同一周期主族元素原子半径的大小,主要看核电荷数的多少。核电荷数越多,则原子的半径越小(稀有气体元素除外)。
如rNa>rMg>rAl;
rN>rO>rF;rP>rS>rCl;
二、离子半径的比较
(一)同主族元素离子半径的大半径,核电荷数越多,离子半径越小。
如rNa+>rMg2+>rAl3+;
②同周期主族元素的阴离子半径,核电荷数越多,离子半径越小。
如rS2->rCl-;rO2->rF-;
但在同一短周期中,阳离子的半径都小于阴离子的半径。这是由于同一短周期中的阳离子总比阴离子少一个电子层。
三、具有相同电子层结构的离子半径的比较有两种情况:
(一)核外电子排布相同的离子,主要看核电荷数的多少。核电荷数越多,离子半径越小;核电荷数越小,离子半径越大。
如rS2->rCl->rK+>rCa2+;
rF-<rNa+<rMg2+<rAl3+;
(二)若同一元素形成几种不同价态的阳离子,主要看价态的高低。价态越高,离子半径越小。
如rFe3+<rFe2+;
四、同种元素原子与离子间半径的比较,主要看核外电子数的多少。核外电子数越多,半径越大;核外电子数越少,半径越小。
如rCl->rCl; rS2->rS; rNa+<rNa;
1、相同元素的原子和离子:
原子半径>阳离子半径
原子半径<阴离子半径
如:半径Na>Na+ Cl<Cl-
2、相同主族的原子,随着原子序数的增加,原子半径或离子半径增大。
如:半径Li<Na<K<Rb<Cs
F<Cl<Br<I
3、同周期的主族元素原子,随着原子序数的增加,原子半径减小。
如:半径Na>Mg>Al>Si>P>S>Cl
4、核外电子排布相同的离子,原子序数越大,离子半径越小。
如:半径Na+>Mg2+ S2->Cl-
小试牛刀
1.原子半径依次减小的是
A.Li、Na、K
B.K、P、N
C.C、Si、S
D.Cl、Br、I
2.下列微粒半径大小比较中,正确的是
A.Na > Al > Mg
B.N > O > F
C.S > F> O
D.K > Mg > Ca
3.下列化合物中阴离子半径和阳离子半径之比最大的是
A.LiI B.NaBr C.KCl D.CsF
4.下列各组微粒半径大小比较中,不正确的是
A.r(K) > r(Na) > r(Li)
B.r(Mg2+) > r(Na+) > r(F-)
C.r(Na+) > r(Mg2+) > r(Al3+)
D.r(Cl