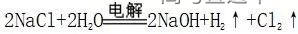一. 电解池工作原理及其应用
1. 原电池、电解池的判定
先分析有无外接电源:有外接电源者为电解池,无外接电源者可能为原电池;然后依据原电池、电解池的形成条件、工作原理分析判定。
2. 电解电极产物的判断:
要判断电极反应的产物,必须掌握离子的放电顺序。判断电极反应的一般规律是:
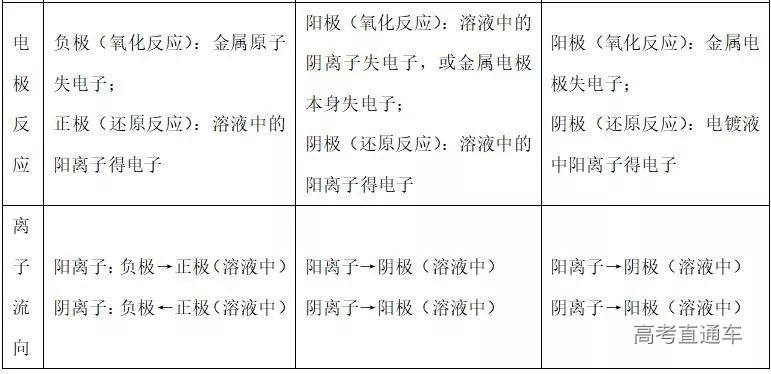
(1) 在阳极上
① 活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。
② 用惰性电极(Pt、Au、石墨、钛等)时,
溶液中阴离子的放电顺序是:S2- >I- >Br- >Cl- >OH- >含氧酸根>F-
(2) 在阴极上:无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子在阴极上放电顺序是:
Ag+ > Fe3+ > Cu2+ > H+ (酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ (水)> Al3+ > Mg2+ >……
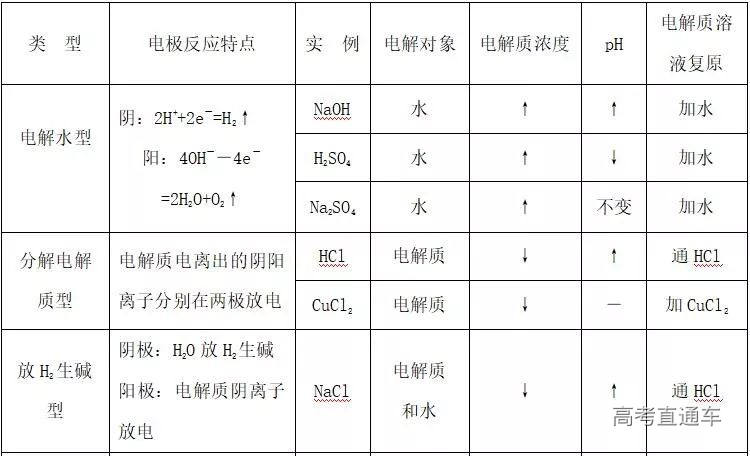
3. 用惰性电极进行溶液中的电解时各种变化情况分析
二. 电解原理在工业生产中的应用
1.电解精炼反应原理(电解精炼铜)
阳极(粗铜,含Fe、Zn、C等):Cu-2e—=Cu2+,
阴极(纯铜):Cu2++2e—=Cu
工作一段时间后,溶液中电解质的成分CuSO4、ZnSO4、FeSO4 ,Cu2+的浓度减小。
2.电镀池:镀铜反应原理
阳极(纯铜):Cu-2e—=Cu2+,阴极(镀件):Cu2++2e—=Cu
溶液中的Cu2+浓度保持不变。
3.氯碱工业反应原理
阳极:2Cl—-2e—=Cl2↑,
阴极:2H++2e—=H2↑
三. 电化学计算的基本方法
原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数测定的计算、根据电荷量求产物的量与根据产物的量求电荷量等的计算。不论哪类计算,均可概括为下列三种方法:
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路中转移的电子数相等。
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
(3)根据关系式计算:利用得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需关系式。
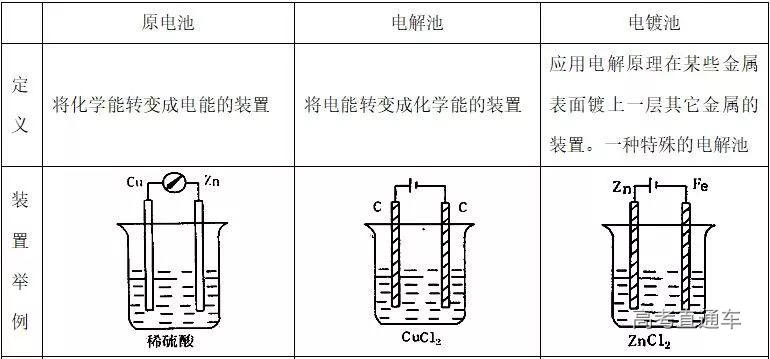
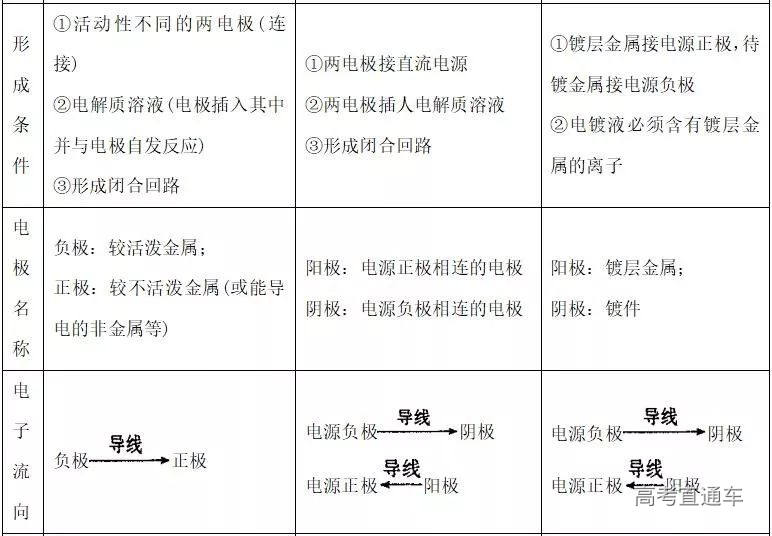
四. 原电池、电解池、电镀池的比较