一、配制一定物质的量浓度的溶液
以配制100mL1.00mol/L的NaOH溶液为例:
1、步骤:(1)计算 (2)称量:4.0g(保留一位小数)(3)溶解(4)转移:待烧杯中溶液冷却至室温后转移(5)洗涤 (6)定容:将蒸馏水注入容量瓶,当液面离刻度线1—2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线在同一水平线上(7)摇匀:盖好瓶塞,上下颠倒、摇匀 (8)装瓶贴标签 :标签上注明药品的名称、浓度。
2、 所用仪器:(由步骤写仪器)
托盘天平、药匙、烧杯、玻璃棒、(量筒)、100mL容量瓶、胶头滴管
3、 注意事项:
(1) 容量瓶:只有一个刻度线且标有使用温度和量程规格,只能配制瓶上规定容积的溶液。(另外使用温度和量程规格还有滴定管、量筒)
(2) 常见的容量瓶:50 mL、100mL、250mL、500mL、1000mL。若配制480mL与240mL溶液,应分别用500mL容量瓶和250mL容量瓶。写所用仪器时,容量瓶必须注明规格,托盘天平不能写成托盘天秤!
(3) 容量瓶使用之前必须查漏。方法:向容量瓶内加少量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,正立,把瓶塞旋转1800后塞紧,再倒立若不漏水,方可使用。(分液漏斗与滴定管使用前也要查漏)
(4)命题角度:一计算所需的固体和液体的量,二是仪器的缺失与选择,三是实验误差分析。
二、Fe(OH)3胶体的制备:
1、步骤:向沸水中加入FeCl3的饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
操作要点:四步曲:①先煮沸,②加入饱和的FeCl3溶液,③再煮沸至红褐色,④停止加热
2、涉及的化学方程式:
Fe3++3H2O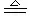
强调之一是用等号,强调之二是标明胶体而不是沉淀,强调之三是加热。
3、命题角度:配制步骤及对应离子方程式的书写
三、焰色反应:
1、 步骤:洗—烧—蘸—烧—洗—烧
2 、该实验用铂丝或铁丝
3 、焰色反应可以是单质,也可以是化合物,是物理性质
4 、Na ,K 的焰色:黄色,紫色(透过蓝色的钴玻璃)
5 、某物质作焰色反应,有黄色火焰一定有Na ,可能有K
6、命题角度:实验操作步骤及Na ,K 的焰色
四、Fe(OH)2的制备:
1、实验现象:白色沉淀立即转化灰绿色,最后变成红褐色沉淀。
2、化学方程式为:
Fe2++2OH-=Fe(OH)2 4e(OH)2+O2+2H2O= 4e(OH)3
3、注意事项:(1)所用亚铁盐溶液必须是新制的,NaOH溶液必须煮沸,(2)滴定管须插入液以下,(2)往往在液面加一层油膜,如苯或食物油等(以防止氧气的氧化)。
4、命题角度:制备过程中的现象、方程式书写及有关采取措施的原因
五、硅酸的制备:
1、步骤:在试管中加入3—5mL饱和Na2SiO3溶液,滴入1—2滴酚酞溶液,再用胶头滴管逐滴加入稀盐酸,边加边振荡,至溶液颜色变浅并接近消失时停止。
2、现象:有透明的硅酸凝胶形成
3、化学方程式:
NaSiO3+2HCl= H2SiO3↓+2NaCl(强酸制弱酸)
4、 NaSiO3溶液由于SiO32-水解而显碱性,从而使酚酞试液呈红色。
六、重要离子的检验:
1、Cl-的检验:加入AgNO3溶液,再加入稀硝酸,若生成不溶于稀HNO3的白色沉淀;或先加硝酸化溶液(排除CO32-干扰),再滴加AgNO3溶液,如有白色沉淀生成,则说明有Cl-存在
2、SO42-的检验:先加入盐酸,若有白色沉淀,先进行过滤,在滤液中再加入BaCl2溶液,生成白色沉淀即可证明。若无沉淀,则在溶液中直接滴入BaCl2溶液进行检验。
命题角度:检验方法、除杂、沉淀洗涤及相关纯度的计算
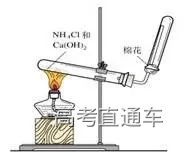
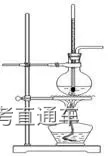
七、氨气的实验室制法
1、反应原理 :
2NH4Cl+Ca(OH)2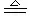
2、收集:向下排空气法(管口塞一团棉花,避免空气对流)
3、验满:①将湿润的红色石蕊试纸放在试管口,若试纸变蓝,说明氨气已收集满 ②将蘸有浓盐酸的玻璃棒靠近试管口,出现大量白烟,则证明氨气已收集满
4、干燥方法:碱石灰干燥(不能无水氯化钙)
5、装置图:固体和固体加热制气体的装置,与制氧气的相同
拓展:浓氨水或浓铵溶液滴到生石灰或烧碱中制氨气,或浓氨水直接加热也可制氨气
6、命题角度:因氨气作为中学化学实验制取气体中唯一的实验,其地位不可估量。主要角度为:反应原理、收集、干燥及验满等,并以此基础进行性质探究实验。
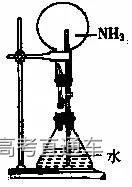
八、喷泉实验
1、实验原理:氨气极易溶于水,挤压胶头滴管,少量的水即可溶解大量的氨气(1:700),使烧瓶内压强迅速减小,外界大气压将烧杯中的水压入上面的烧瓶,故NH3、HCl、HBr 、HI、 SO2 等气体均能溶于水形成喷泉。
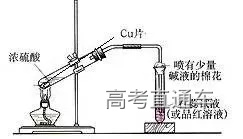
九、铜与浓硫酸反应的实验
1、实验原理:
Cu+2H2SO4(浓)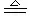
2、现象:加热之后,试管中的品红溶液褪色,
或试管中的紫色石蕊试液变红;将反应后的溶液倒入盛有水的烧杯中,溶液由黑色变成蓝色。
3、原因解释:变黑的物质为被浓硫酸氧化生成CuO,CuO与冲稀的硫酸反应生成了CuSO4溶液。
【提示】由于此反应快,利用铜丝,便于及时抽出,减少污染。
命题角度:SO2的性质及产物的探究、“绿色化学”及尾气的处理等。
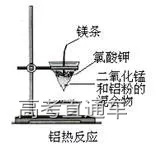
十、铝热反应:
1、实验操作步骤:把少量干燥的氧化铁和适量的铝粉均匀混合后放在纸漏斗中,在混合物上面加少量氯酸钾固体中,中间插一根用砂纸打磨过的镁条,点燃。
2、实验现象:立即剧烈反应,发出耀眼的光芒,产生大量的烟,纸漏斗被烧破,有红热状态的液珠,落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
3、化学反应方程式:
Fe2O3+2Al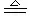
4、注意事项:
(1)要用打磨净的镁条表面的氧化膜,否则难以点燃。
(2)玻璃漏斗内的纸漏斗要厚一些,并用水润湿,以防损坏漏斗
(3)蒸发皿要垫适量的细沙:一是防止蒸发皿炸裂,二是防止熔融的液体溅出伤人。
(4)实验装置不要距人太近,防止使人受伤。
5、命题角度:实验操作步骤及化学方程式。
十一、中和热实验(了解):
1、概念:酸与碱发生中和反应生成1 mol水时所释放的热量
注意:(1)酸、碱分别是强酸、强碱 对应的方程式:
H++OH-=H2O △H=-57.3KJ/mol
(2)数值固定不变,它与燃烧热一样,因具有明确的含义,故文字表达时不带正负号。
2、中和热的测定注意事项:
(1)为了减少误差,必须确保热量尽可能的少损失,实验重复两次,去测量数据的平均值作计算依据
(2)为了保证酸碱完全中和常采用H+或OH-稍稍过量的方法
(3)实验若使用了弱酸或弱碱,引种和过程中电离吸热,会使测得的中和热数值偏小
十二、酸碱中和滴定实验(了解):
(以一元酸与一元碱中和滴定为例)
1、原理:C酸V酸=C碱V碱
2、要求:①准确测算的体积. ②准确判断滴定终点
3、酸式滴定管和碱式滴定管的构造:①0刻度在滴定管的上端,注入液体后,仰视读数数值偏大 ②使用滴定管时的第一步是查漏 ③滴定读数时,记录到小数点后两位 ④滴定时一般用酚酞、甲基橙作指示剂,不用石蕊试液。④酸碱式滴定管不能混用,如酸、具有氧化性的物质一定用酸式滴定管盛装。
4、操作步骤(以0.1 molL-1的盐酸滴定未知浓度的氢氧化钠溶液为例)
①查漏、洗涤、润洗
②装液、赶气泡、调液面、注液(放入锥形瓶中)
③滴定:眼睛注视锥形瓶中溶液中溶液颜色的变化,当滴到最后一滴,溶液颜色发生明显变化且半分钟内部不变色即为滴定终点
5、命题角度:滴定管的结构、读数及中和滴定原理。
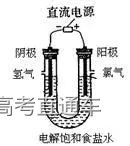
十三、氯碱工业:
1、实验原理:电解饱和的食盐水的电极反应为:
2NaCl+2H2O
2、应用:电解的离子方程式为
2Cl-+2H2O
阴极产物是H2和NaOH,阴极被电解的H+是由水电离产生的,故阴极水的电离平衡被破坏,阴极区溶液呈碱性。若在阴极区附近滴几滴酚酞试液,可发现阴极区附近溶液变红。阳极产物是氯气,将湿润的KI淀粉试纸放在阳极附近,试纸变蓝。
3、命题角度:两极上析出产物的判断、产物的性质及相关电解原理
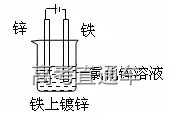
十四、电镀:
(1)电镀的原理:与电解原理相同。电镀时,一般用含有镀层金属阳离子的电解质溶液作电镀液,把待镀金属制品浸入电镀液中,与直流电源的负极相连,作阴极;用镀层金属作阳极,与直流电源的正极相连,阳极金属溶解,成为阳离子,移向阴极,这些离子在阴极上得电子被还原成金属,覆盖在镀件的表面。
(2)电镀池的组成:待镀金属制品作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,阳极反应:M – ne- =Mn+(进入溶液),阴极反应Mn++ ne- =M(在镀件上沉积金属)
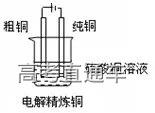
十五、铜的精炼:
(1)电解法精炼炼铜的原理:
阳极(粗铜):
Cu-2e-=Cu2+、Fe-2e-=Fe2+
阴极 (纯铜):
Cu2++2e-=Cu
(2)问题的解释:铜属于活性电极,电解时阳极材料发生氧化反应而溶解。粗铜中含有Zn、Ni、Fe、Ag、Au等多种杂质,当含有杂质的铜在阳极不断溶解时,位于金属活动性顺序表铜以前的金属杂质,如Zn、Ni、Fe、等也会同时失去电子,但它们的阳离子得电子能力比铜离子弱,难以被还原,所以并不能在阴极上得电子析出,而只能留在电解液里,位于金属活动性表铜之后的银、金等杂质,因失去电子的能力比铜更弱,难以在阳极失去电子变成阳离子溶解,所以以金属单质的形式沉积在电解槽底,形成阳极泥(阳极泥可作为提炼金、银等贵重金属的原料)。
(3)命题角度:精炼原理及溶液中离子浓度的变化
十六、卤代烃中卤原子的检验方法(取代反应、消去反应):
1、实验步骤:
2、若为白色沉淀,卤原子为氯;若浅黄色沉淀,卤原子为溴;若黄色沉淀,卤原子为碘
3、卤代烃是极性键形成的共价化合物,只有卤原子,并无卤离子,而AgNO3只能与X—产全AgX沉淀,故必须使卤代烃中的—X转变为X—,再根据AgX沉淀的颜色与质量来确定卤烃中卤原子的种类和数目,
4、加入硝酸银溶液之前,须加入硝酸酸化中和掉混合液中的碱液方可。5、用酸性KMnO4溶液验证消去反应产物乙烯时,要注意先通入水中除去乙醇,再通入酸性KMnO4溶液中;也可用溴水直接检验(则不用先通入水中)。
十七、乙烯的实验室制法:
1、反应制取原理:
C2H5OH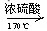
2、液液加热型,与实验室制氯气制法相同。
3.浓硫酸的作用:催化剂、脱水剂
4.注意事项:①乙醇和浓硫酸的体积比为1:3
② 向乙醇中注入浓硫酸;边慢注入,边搅拌
③温度计水银球插到液面以下
④反应温度要迅速升高到170℃
⑤该实验中会产生副产物SO2,故检验乙烯时,一定先用碱液除去SO2,再通入KMnO4或溴水
5.本反应可能发生的副反应:
C2H5OH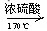
C2H5-OH+ HO-C2H5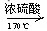
C+2H2SO4(浓)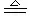
十八、乙酸乙酯的制备
注意事项:1、先加乙醇,再加浓硫酸和乙酸的混合液;2、低温加热小心均匀的进行,以防乙酸、乙醇的大量挥发和液体剧烈沸腾;3、导气管末端不要插入饱和Na2CO3液体中,防液体倒吸。
4、用饱和Na2CO3溶液吸收主要优点:
= 1 \*GB3 ①吸收乙酸,便于闻于乙酸乙酯的香味 ②溶解乙醇 ③ 降低乙酸乙酯的溶解度,分层,观察乙酸乙酯
5、本反应的副反应:
C2H5-OH+ HO-C2H5
C+2H2SO4(浓)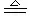
6、命题角度:加入药品顺序、导管的位置、饱和Na2CO3溶液的作用及考查运用化学平衡提高乙酸乙酯转化率的措施。
十九、醛基的检验(以乙醛为例):
A:银镜反应
1、银镜溶液配制方法:在洁净的试管中加入1ml 2%的AgNO3溶液(2)然后边振荡试管边逐滴加入2%稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
反应方程式:
AgNO3+NH3·H2O=AgOH+NH4 NO3
AgOH+2 NH3·H2O=Ag(NH3)2OH+2H2O
2、银镜实验注意事项:(1)沉淀要恰好溶解(2)银氨溶液随配随用,不可久置
(3)加热过程不能振荡试管 (4)试管要洁净
3、做过银镜反应的试管用稀HNO3清洗
B:与新制Cu(OH)2悬浊液反应:
1、Cu(OH)2悬浊液配制方法:在试管里加入10%的NaOH溶液2ml,滴入2%的CuSO4溶液4—6滴,得到新制的氢氧化铜悬浊液
2、注意事项:(1)Cu(OH)2必须是新制的(2)要加热至沸腾(3)实验必须在碱性条件下(NaOH要过量)
二十、蔗糖与淀粉水解及产物的验证:
1、实验步骤:在一支洁净的试管中加入蔗糖溶液,并加入几滴稀硫酸,将试管放在水浴中加热几分钟,然后用稀的NaOH溶液使其呈弱碱性。
2、注意事项:用稀硫酸作催化剂,而酯化反应则是用浓硫酸作催化剂和吸水剂。
在验证水解产物葡萄糖时,须用碱液中和,再进行银镜反应或与新制Cu(OH)2悬浊液的反应。
备注:点击右上角,复制链接,即可将页面发给打印店打印哦!收藏即可随时随地查看!觉得有用,欢迎分享给更多同学!