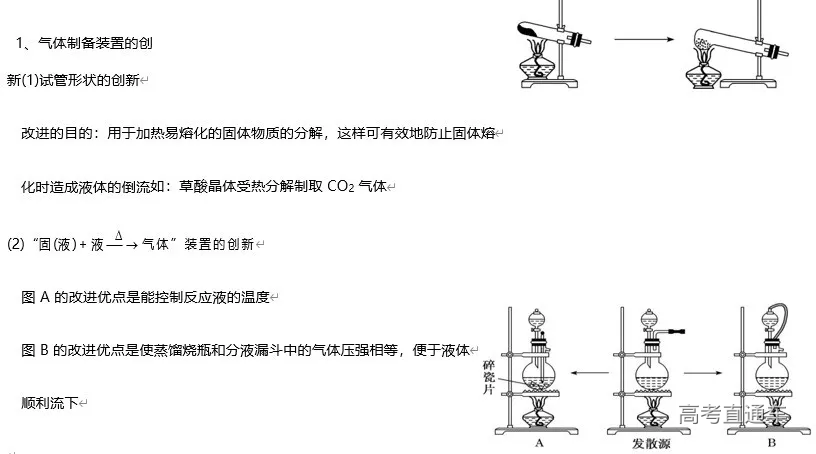
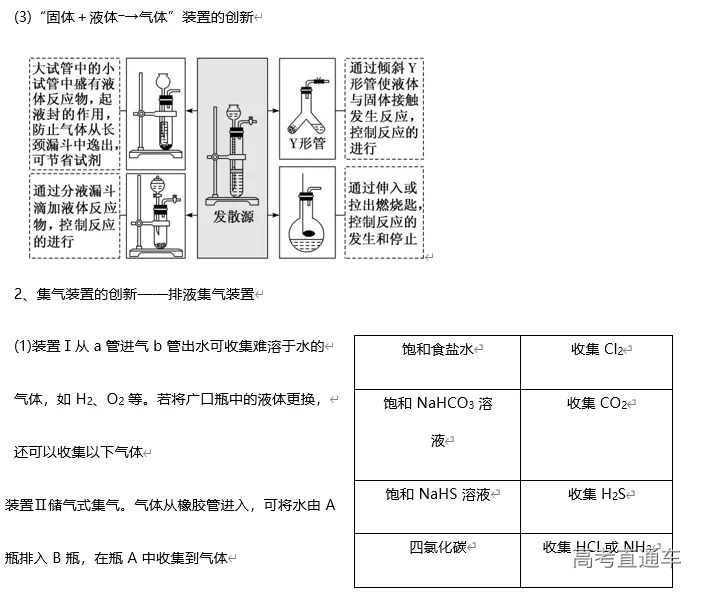
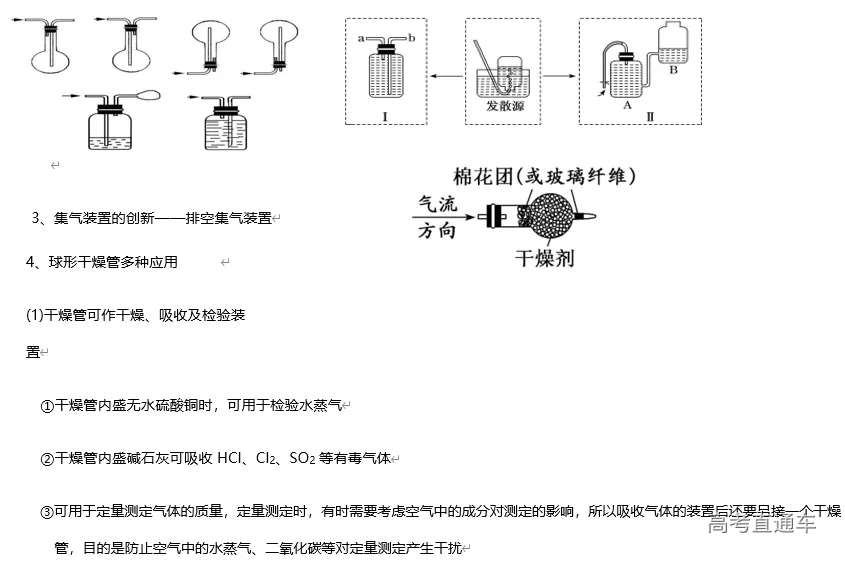
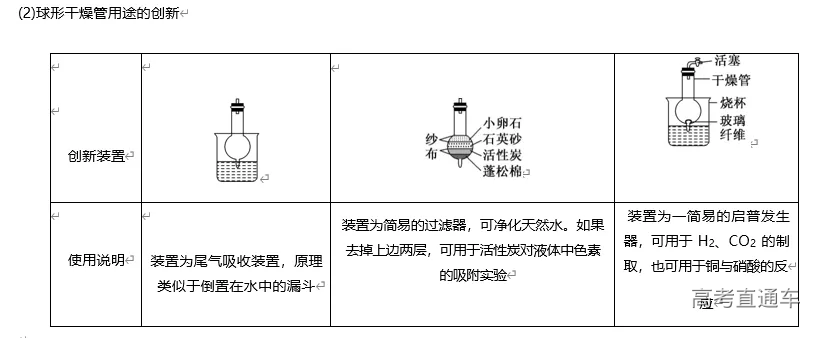
2020高考化学实验专题复习
一、三大气体制备装置的连接
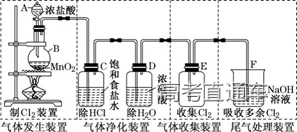
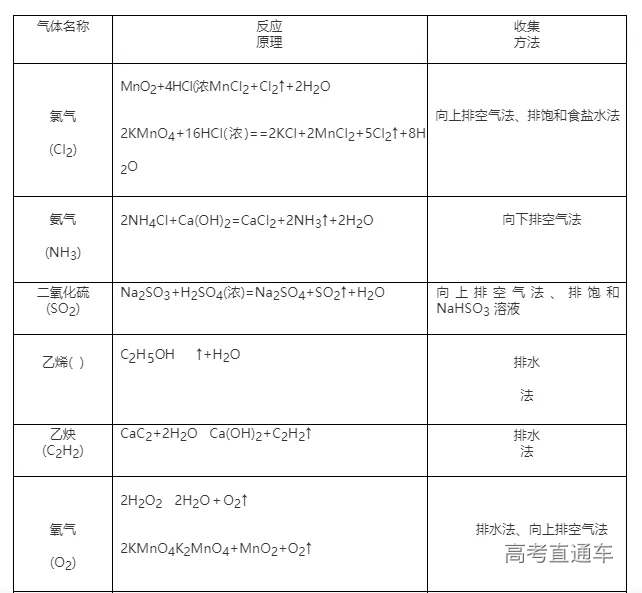
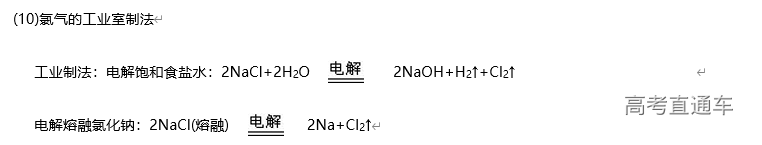
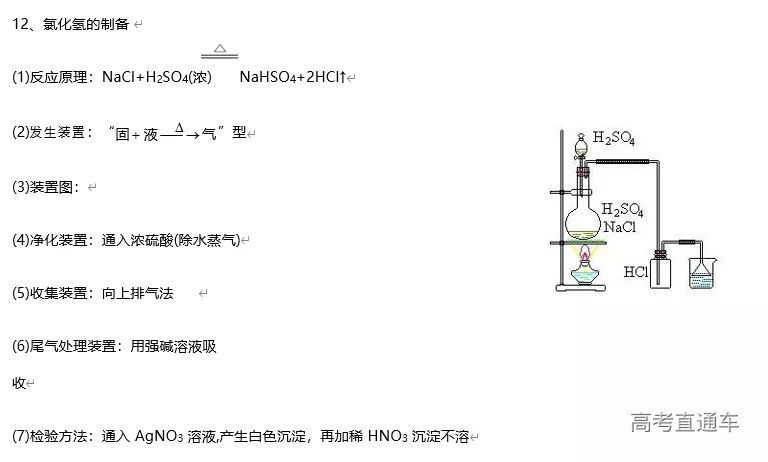
1、Cl2 的实验室制备系统
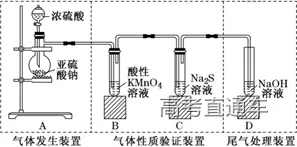
2、SO2的实验室制备系统
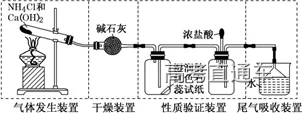
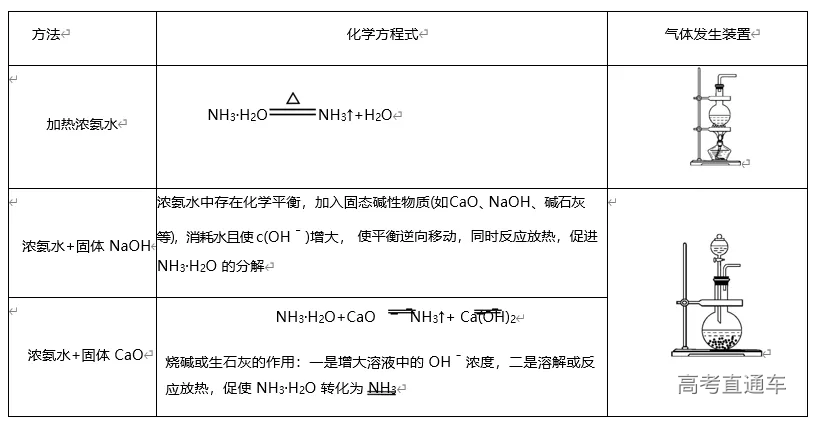
3、NH3 的实验室制备系统
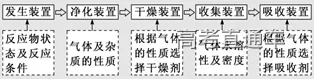
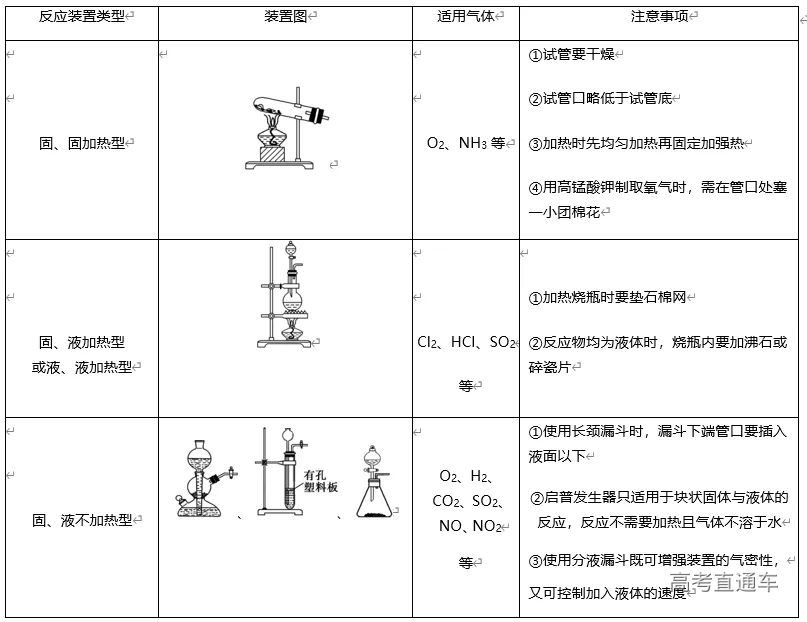
4、实验装置选择的思路:
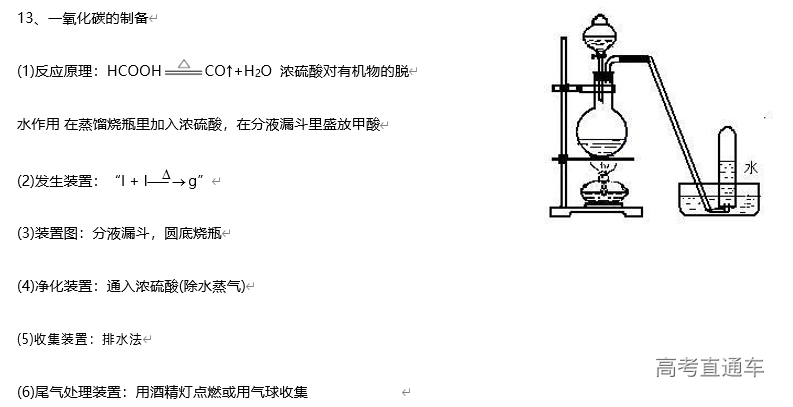
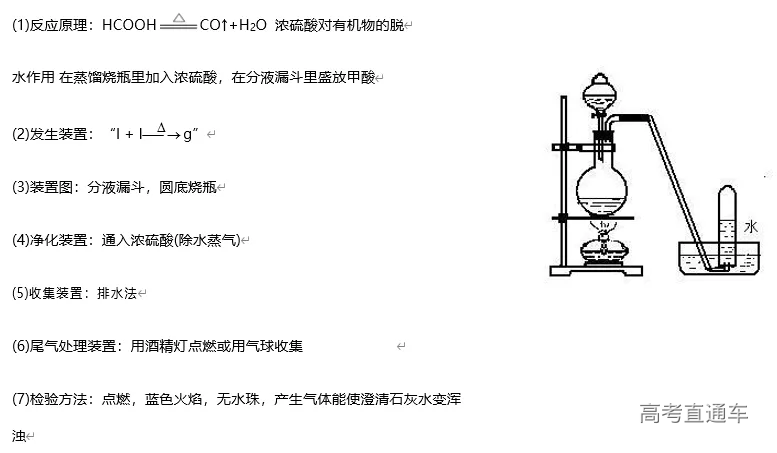
二、气体的制备
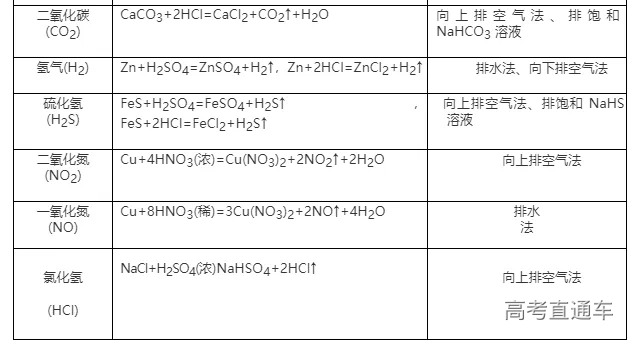
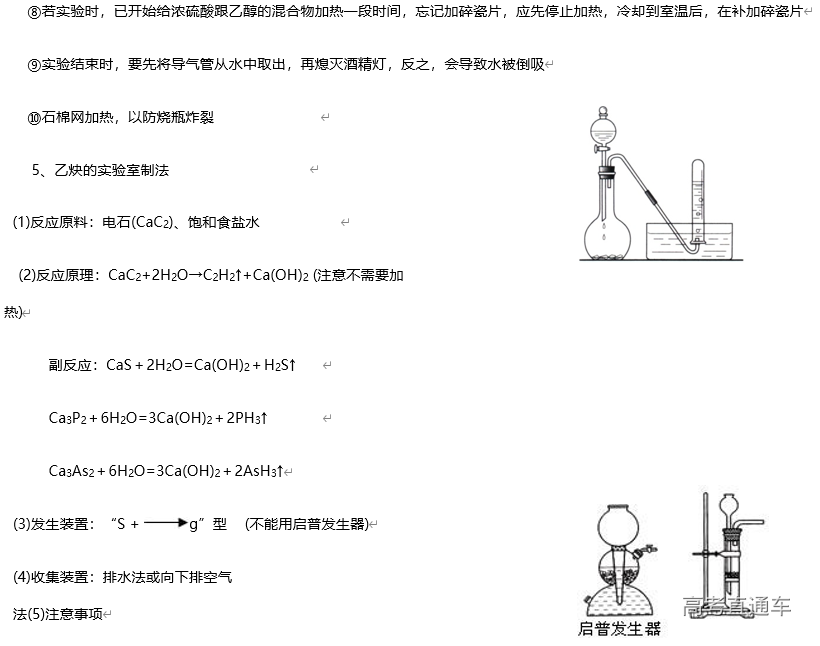
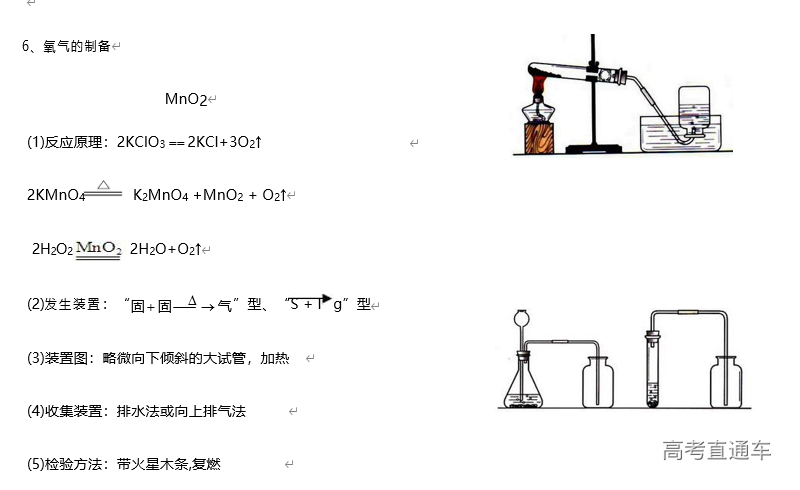
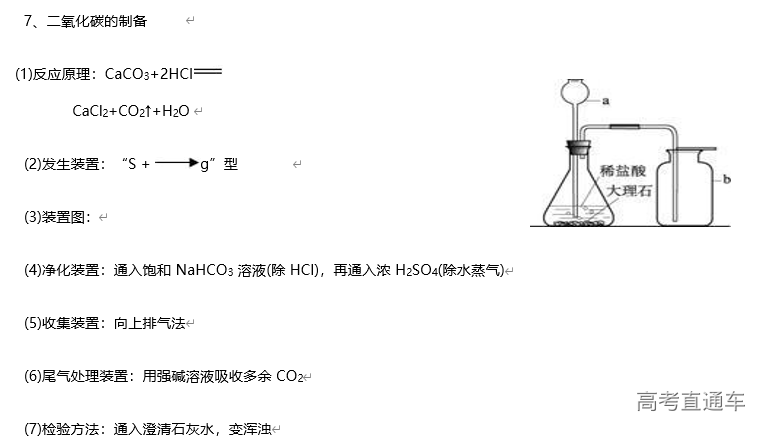
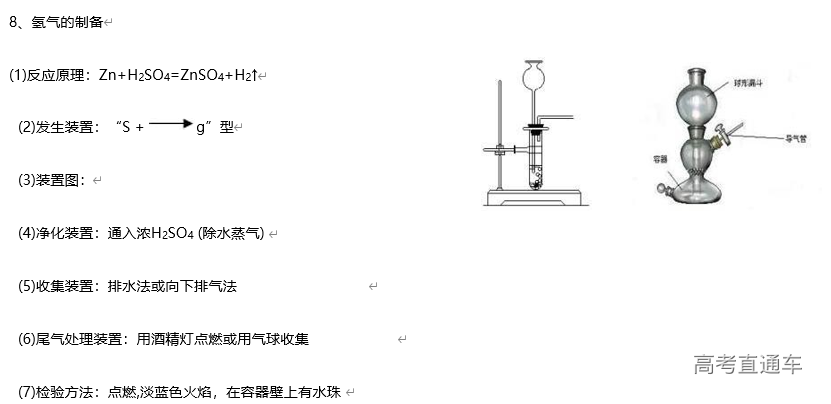
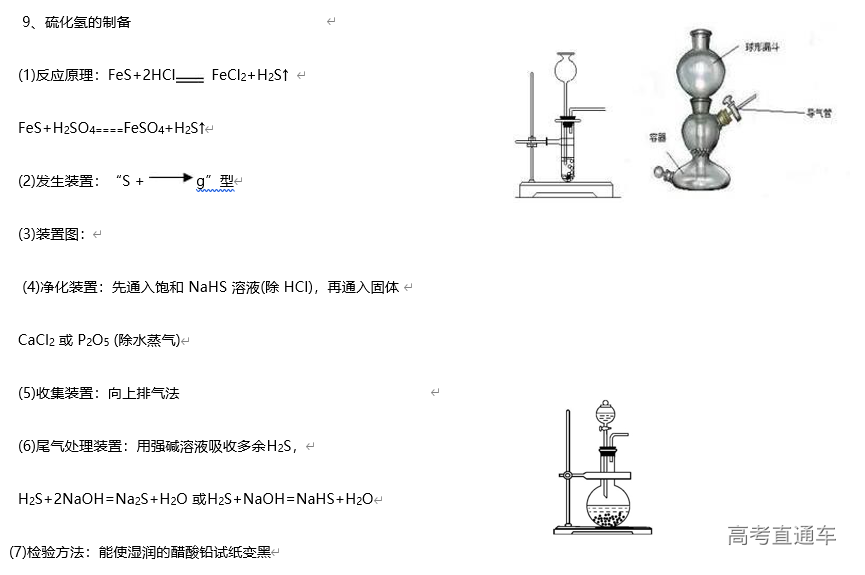
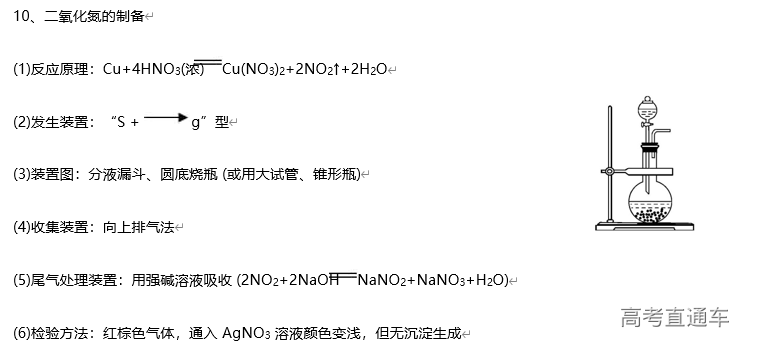
1、常见气体制备的反应原理
试剂的选择:以实验室常用药品为原料,依据制气原理,选择方便、经济、安全的试剂,尽量做到有适宜的反应速率,且所得气体比较纯净。如:用锌粒与酸制取氢气,一般选择稀硫酸,而不用稀盐酸,原因是盐酸是挥发性酸,制取的氢气中常混有HCl 气体
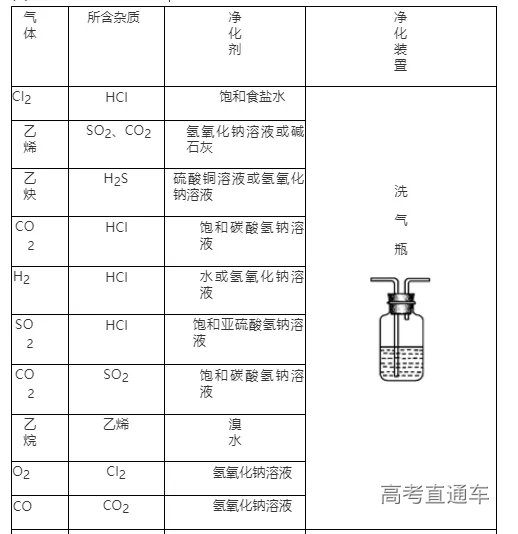
3、气体的净化装置
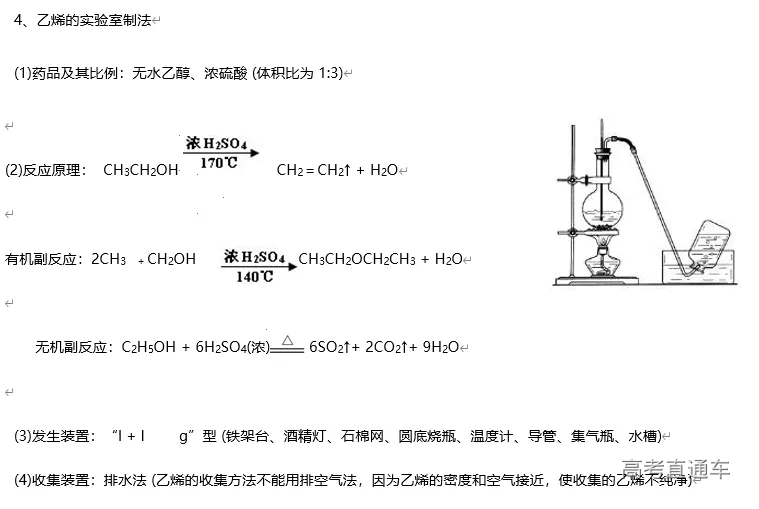
(1)判断气体中的杂质方法:凡是反应物中有易挥发性液体,如盐酸、浓硝酸、溴水等,制得的气体中一定含有相应的杂质HCl、HNO3、溴蒸气及水蒸气等。还有一些发生副反应的,如用酒精和浓硫酸反应制乙烯时,由于副反应的发生而使乙烯中含有杂质SO2、CO2 和水蒸气
(2)除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体
(3)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性
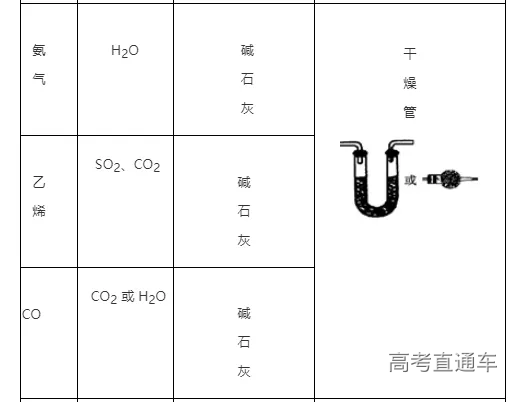
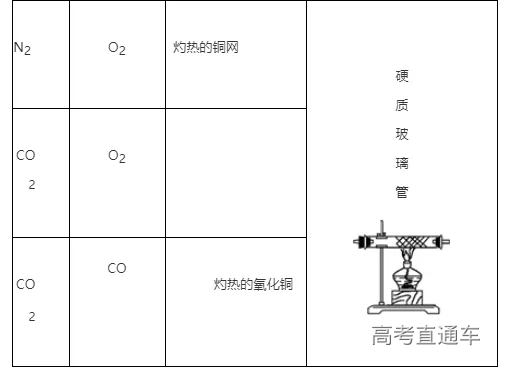
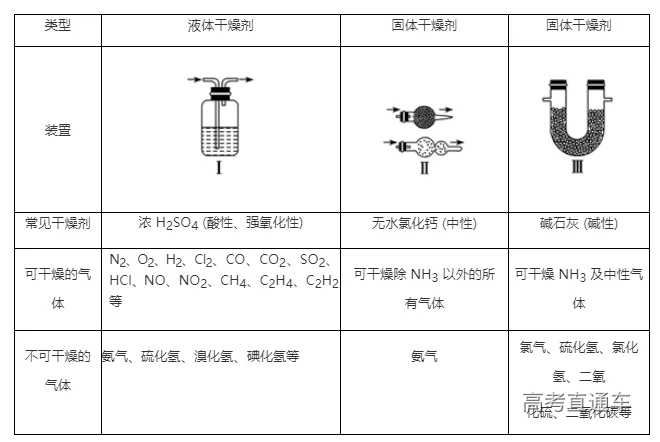
(4)根据试剂选择合适的装置:洗气瓶、球形干燥管、U 形管、硬质玻璃管
(5)除杂顺序:先除杂,后除水
(6)常见气体的净化实例
气体的干燥是指除去气体中所含的水蒸气,实质上也属于除杂范畴(是一种特定的除杂过程);气体干燥的关键是选择干燥剂,并根据干燥剂的状态选择干燥装置,常用的装置有洗气瓶、干燥管等
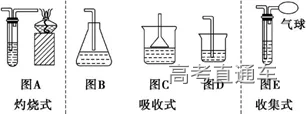
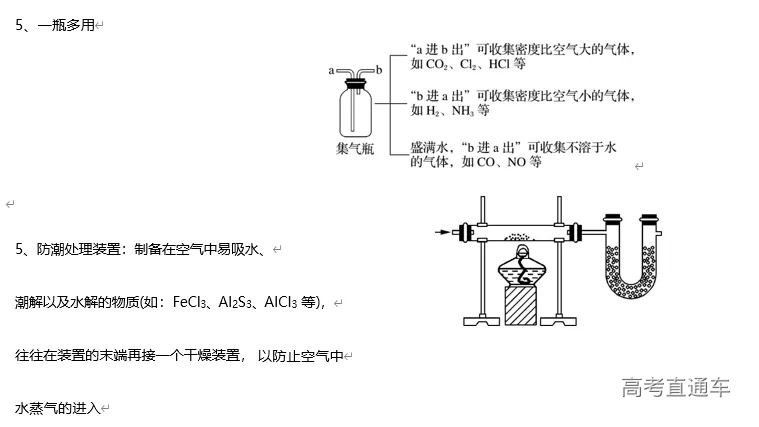
收集方法 | 排水法 | 向上排空气法 | 向下排空气法 |
收集原理 | 收集的气体不与水反应或难溶于水 | 与空气不反应且密度比空气的大 | 与空气不反应且密度比空气的小 |
收集装置 | | | |
适用的气体 | H2、O2、NO、CH4、C2H4 等 | Cl2、CO2、NO2、SO 2 | H2、NH3 |
6、尾气处理装置
(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害
(2)处理方法:
①转化处理:一般根据气体的相关性质,用溶液吸收或点燃使它们变为无毒、无害、无污染的物质,使其转化为非气态物质或无毒物质。实验室中常见有毒气体的处理方法如表所示
Cl2 | SO2 | NO2 | H2S | HCl | NH3 | CO、H2 | NO |
NaOH 溶液 | 硫酸铜溶液或NaOH 溶液 | 水 | 水或硫酸溶液 | 点燃 | 与氧气混合后通入 NaOH 溶液 | ||
②直接排入空气中:主要是针对无毒、无害气体的处理。如:N2、O2、CO2 等
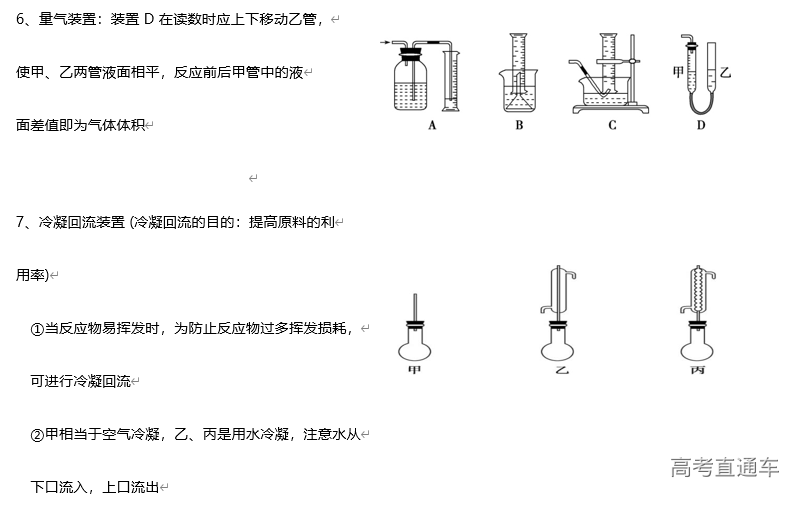
(3)吸收原则:能充分吸收气体;不能倒吸(4)常见装置
①吸收溶解度较小的尾气(如:Cl2 等)用图D 装置
②吸收溶解度较大的尾气(如:HCl、NH3等)用图 B、C装置 (防倒吸)
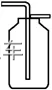
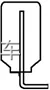
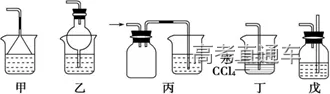
(5)防倒吸装置(以氨气吸收为例)
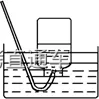
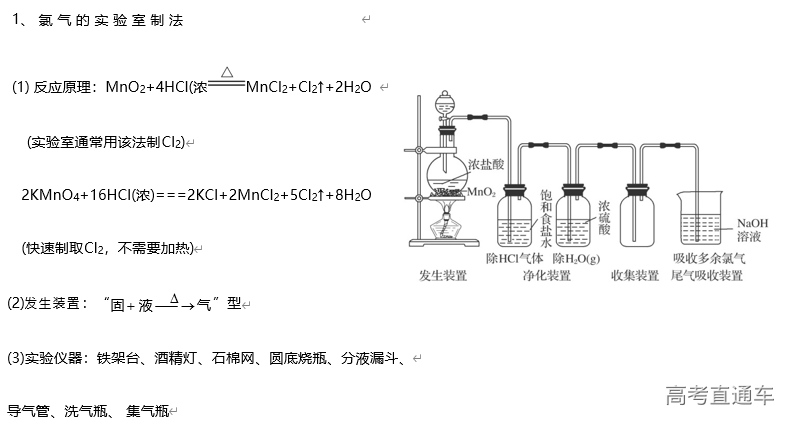
①液体容纳:图甲、乙原理相同,当易溶性气体被吸收液吸收时,导管内压强减小,吸收液上升到漏斗或干燥管中,导致烧杯中液面下降;使漏斗口、干燥管脱离液面,吸收液受自身重力作用又流回烧杯内,从而防止吸收液倒吸
②安全瓶:如图丙所示,当吸收液发生倒吸时,倒吸进来的吸收液进入安全瓶,从而防止吸收液进入受热仪器或反应容器,起到防倒吸作用
③间接吸收:如图丁所示,NH3、HCl 等易溶于水却不溶于 CCl4的气体,在 CCl4中形成气泡,增大与水的接触面积,进行间接吸收,可以达到防倒吸的目的
④气压平衡:如图戊所示,为防止反应体系的压强减小引起吸收液的倒吸,可以在密闭系统中连接一个与大气相通的液封玻璃管,保持瓶内压强等于大气压而防止倒吸
三、创新型实验
四、常见气体制备的反应原理