推荐阅读:
1、HCN中C的化合价?
HCN分子结构式为H-C≡N,电负性(吸电子能力) N>C>H,则碳氮三键的电子对偏向原子,N为-3价,碳在这里为+3;但碳氢单键的电子偏向碳,电子指定给碳,碳就得到了1个电子,这部分碳显-1;氢就为+1.碳两部分加起来:+3+(-1)=+2,就是+2价.
2、KSCN中硫为-2价,则C为多少价?
C为+4价,N为-3,S为-2
注:硫氰化氢H—S—C≡N,异硫氰酸H—N=C=S两种。但元素化合价相同。
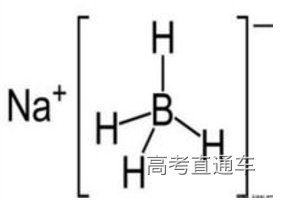
3、NaBH4中氢的化合价?
NaBH4为离子化合物,BH4-为四面体结构 ,化合价可认为B只有+3,H为-1价。
可见,若能写出结构式,则可据电负性分析电子对的偏向与偏移,标出化合价
4、FeCuS2中S的化合价?Fe5O7呢?
S为-2,变形为FeS·CuS,Fe5O7,变形为FeO·Fe2O3,易分析。
变形法能分析陌生化合物中元素化合价,甚至能分析化合物的形成方法及分解产物。
5、SiH4中H的化合价?
H为-1价,电负性:Si—1.9,H—2.2,即电子对偏向电负性大的原子一边。
注:NH3中N-3,H+1;
NH4+中N-3,H+1;
CH4中C-4,H+1.
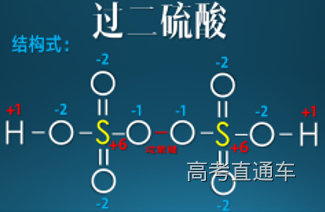
6、Na2S2O8中硫的化合价?
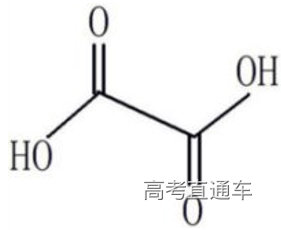
7、草酸中碳的化合价?
其实,无机物与有机物是相通的,分析方法可借用。
8、关于碳元素的化合价
碳原子的最外层上的电子数目为4,最多有四次成键的机会。有机物中的碳原子能且只能成键4次。
(1)碳元素只有同氢元素结合时才显负价,即C—H中C为-1价,故甲烷中碳为-4价。
(2)碳元素同其它非金素元素结合时都显正价,如:C—X中C为+1价,C—O中C为+1价,C—N中C为+1价,C=O中C为+2价,C≡N中C为+3价。所以,H-C≡N中C为+2价。
(3)碳原子与碳原子相结合时均为0价,即C—C、C=C、C≡C中全为0价。形成CH3CH3、CH2=CH2、CH≡CH后,碳的化合价分别为:-3、-2、-1.
总结归纳:根据有机物的分子结构确定C元素的化合价。
根据有机物的分子式计算C元素的表观化合价。
9、SiHCl3中的化合价,CHCl3呢?CH2Cl2呢?
通过下表的化合价:Cl>C>H>Si,知道CH4中C为-4,SiH4中Si为+4.
SiHCl3中H为-1价,Si为+4价,
分子中原子的连接方式CH4中4个C-H,共用电子对都偏向C,那么C就是-4价 而在CCl4中,共用电子对都偏离C,那么C就是+4价
在CHCl3中,1个C-H,共用电子对都偏向C,那么C就是-1价;还有3个C-Cl键,共用电子对都偏离C,那么C就是+3价 ,加起来C就是+2价。
CH2Cl2呢?2个C-H,共用电子对都偏向C,那么C就是-2价;还有2个C-Cl键,共用电子对都偏离C,那么C就是+2价,加起来C就是0价。
总之,主要靠结构式、电负性帮助我们判断元素的化合价!
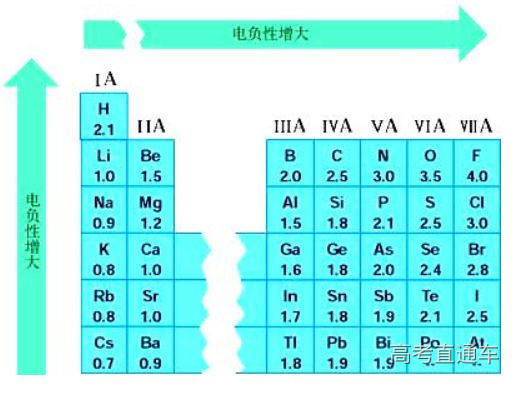
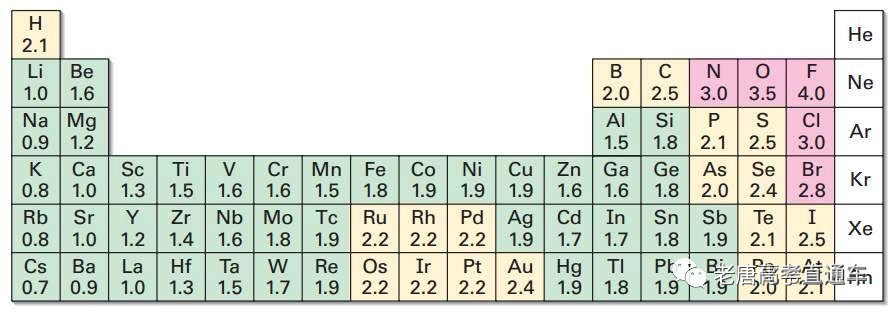
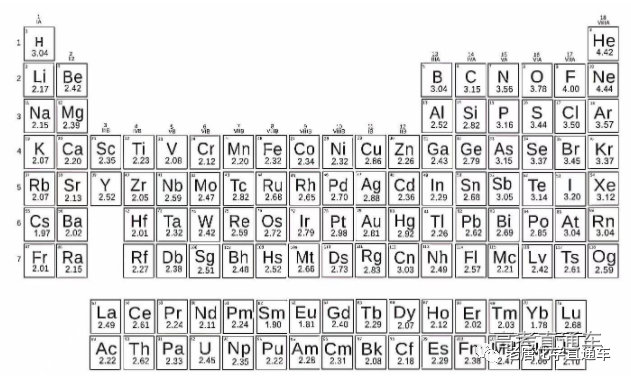
附电负性表:
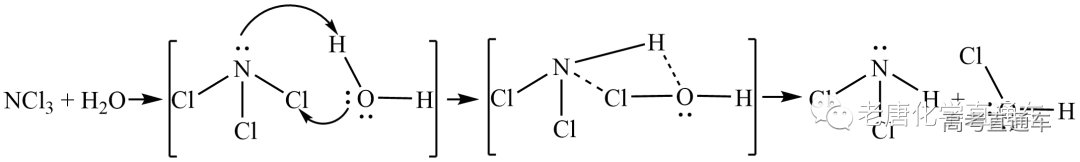
10.如何判断NCl3中各元素的化合价?
N、Cl的电负性相同,如何判断NCl3 中各 元素的化合价呢?基于NCl3 的水解产物来看:若不考虑NH3 被HClO氧化,NCl3水解的总反应可表示为:NCl3+3H2 O==NH3 +3HClO (实际反应可能要复杂些,与反应的酸碱性环境有关) 酸性环境:2NCl3 +3H2O==N2 +3HClO
N、Cl的电负性相同,如何判断NCl3中各 元素的化合价呢?
基于NCl3的水解产物来看:若不考虑NH3被HClO氧化,NCl3水解的总反应可表示为:NCl3+3H2O==NH3+3HClO (实际反应可能要复杂些,与反应的酸碱性环境有关) 酸性环境:2NCl3+3H2O==N2+3HClO+3HCl 碱性环境:2NH3+HClO+OH-==N2H4+Cl-+2H2O 最终NH3被HClO氧化为N2或N2H4。
反应机理
比较N、Cl的非金属性:
1、NH3能形成分子间氢键而HCl分子间没有氢键(或只有很弱的氢键)可以证实:N的非金属性略强于Cl,因此,NCl3中N为-3价,Cl为+1价。
2、元素非金属性的强弱判据:
①不同元素对应简单气态氢化物的稳定性
②最高价氧化物对应的水化物的酸性
③置换反应
但是,由酸性:HClO4>HNO3,得出非金属性:Cl>N,这一结论是不严谨的。这种方法大部分时候只适用于同周期或同主族元素非金属性强弱的比较。
比较N、Cl的电负性:
高中各版本化学教材所引用的电负性数据,都是沿用徐光宪《物质结构简明教程》的 数据表,表中列出的N和Cl的鲍林(L. Pauling)电负性均为3.0。
实际上,对同一个概念,标度不同,其数值也会不同。电负性数据表历史上常用 的有3种系统:1932年——鲍林标度、1934年——马利肯标度、1957年——阿莱﹣罗周标度。虽然最常使用的电负性定义仍然是鲍林电负性标度,但其适用范围不广,且在预言化学反应或化学键的极性时会偶尔失效,因此化学家们不断发展出了新的电负性标度。
在阿莱-罗周电负性标度中,χN=3.07>χCl=2.83;
在一种新的电负性标度—轨道电负性(χO)标度中,N和Cl的轨道电负性χO分别约为3.19和 3.10;
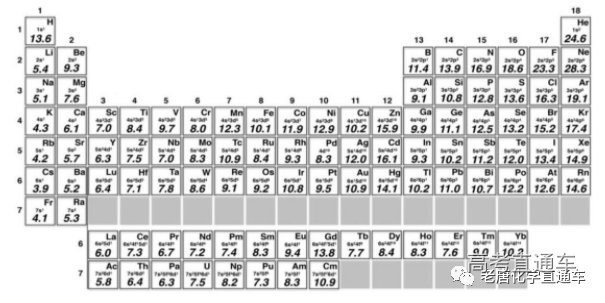
2019年的《美国化学会志》刊发了 瑞典化学家Martin Rahm、加拿大化学家 Tby Zng、以及1981年诺奖得主Roald Hoffmann提出基于价电子平均结合能的 电负性标度。其中,N和Cl的电负性分别 为16.9和16.3;
基于价电子平均结合能的电负性标度中部分元素的电负性数据
2021年的《自然-通讯》中刊发了 两名俄罗斯化学家Artem Oganov和 Christian Tantardini对鲍林电负性进行 修订后的电负性数据,N和Cl的电负性 分别为3.56和3.50。
2021年Artem oganov等修正后的鲍林电负性数据
结论:N的电负性略强于Cl。因此,NCl3中N为-3价,Cl为+1价。